tabel unsur unsur kimia
Tabel periodik pertama yang dibuat oleh Dmitri Mendeleev dan diterbitkan pada tahun 1869.
Mendeleev telah menemukan dan dia bisa mengatur 65 unsur-unsur yang kemudian dikenal dalam kotak atau meja sehingga masing-masing elemen:
1. Sebuah berat atom lebih tinggi dari yang di kiri.
2. Mirip sifat kimia unsur-unsur lain dalam kolom yang sama.
Dia menyadari bahwa meja di depannya terletak di jantung kimia. Di meja, ia mencatat kesenjangan – ruang di mana elemen harus tetapi tidak ada yang belum pernah ditemukan.
Bahkan, seperti Adams dan Le Verrier bisa dikatakan telah menemukan planet Neptunus di atas kertas, Mendeleev bisa dikatakan telah menemukan germanium (yang disebutnya eka-silikon karena ia mengamati kesenjangan antara silikon dan timah), gallium (eka-aluminium) dan skandium (eka-boron) di atas kertas, karena ia meramalkan keberadaan mereka dan sifat mereka sebelum penemuan mereka yang sebenarnya.
Meskipun Mendeleev telah membuat terobosan penting, dia membuat sedikit kemajuan karena model Rutherford-Bohr atom belum dirumuskan.
Pada tahun 1913, Henry Moseley, yang bekerja dengan Rutherford, menunjukkan hal itu adalah nomor atom (charge) dan tidak (seperti yang telah diusulkan Mendeleev) berat atom yang paling mendasar terhadap sifat kimia dari setiap elemen. Seperti Mendeleev, Moseley bisa memprediksi dengan benar keberadaan unsur-unsur baru berdasarkan karyanya.
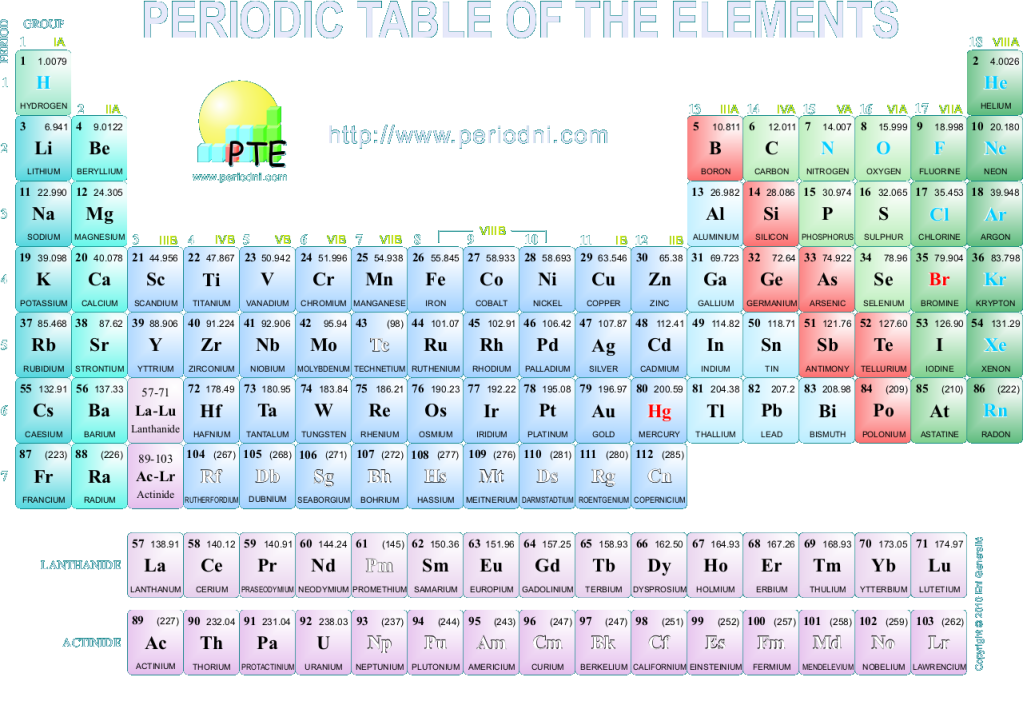
Dan hari ini elemen masih diatur dalam urutan nomor atom (Z) sebagai Anda pergi dari kiri ke kanan di atas meja. Kami menyebutnya periode baris horizontal dan vertikal baris kelompok.
Kita juga tahu kimia unsur ditentukan oleh cara elektron disusun – konfigurasi elektronnya.
Gas mulia ditemukan dalam kelompok 18, di paling kanan dari setiap periode. Keengganan gas mulia untuk mengalami reaksi kimia menunjukkan bahwa atom-atom gas ini sangat suka konfigurasi elektron mereka sendiri – yang menampilkan kulit luar penuh elektron – untuk lain.
Berbeda dengan gas mulia, unsur-unsur dengan reaktivitas tertinggi adalah mereka dengan kebutuhan terbesar untuk mendapatkan atau kehilangan elektron untuk mencapai kulit luar penuh elektron.
Elemen duduk di grup yang sama (misalnya logam alkali di Grup 1) semua memiliki jumlah elektron yang sama luar, yang mengarah ke sifat kimia yang mirip.
Demikian pula di Grup 17 halogen juga memiliki sifat yang mirip satu sama lain. Ketika halogen bereaksi, mereka memperoleh elektron untuk membentuk ion negatif dibebankan. Setiap. Ion memiliki konfigurasi elektron yang sama seperti gas mulia dalam periode yang sama Ion-ion sehingga lebih kimia stabil dari unsur-unsur dari mana mereka terbentuk.
Ada perkembangan dari logam untuk non-logam di setiap periode.
Blok elemen dalam kelompok 3-12 berisi logam transisi;. Ini adalah serupa satu sama lain banyak dengan cara-cara mereka menghasilkan senyawa berwarna, memiliki valensi variabel dan sering digunakan sebagai katalis. Unsur-unsur tanah jarang dapat dibagi menjadi lantanida (elemen 58-71) dan aktinida (elemen 90-103). Bumi yang terjadi secara alami jarang ditemukan di bumi hanya dalam jumlah yang sangat kecil No. Yang aktinida meliputi sebagian besar terkenal unsur-unsur yang mengambil bagian dalam atau diproduksi oleh reaksi nuklir. unsur dengan nomor atom lebih tinggi dari 92 terjadi secara alami. Hal-hal tersebut dihasilkan secara artifisial dalam reaktor nuklir atau akselerator partikel.
Tidak ada komentar:
Posting Komentar